方法开发注意事项
色谱柱选择
理想情况下,若使用一种色谱柱填料就能满足包括普通肽(含酸性、碱性和非极性残基混合物)、碱性肽、大分子肽(30~40个残基)和疏水性肽在内的所有样品分析需求,色谱柱库存将大大减少,用户无需再为不同粗制样品筛选多根色谱柱。C18固定相是许多肽分离常用的固定相,而键合至C18固定相的基质颗粒也是影响色谱保留性、分离度和峰形的重要因素。XBridge Peptide BEH肽分析专用柱基于亚乙基桥杂化颗粒,而非纯硅胶。BEH(乙氧基硅烷/硅胶桥杂化)颗粒(图7)与肽的次级相互作用极低,在高/低pH条件下均十分稳定,能够为分离方法开发提供极大的灵活性。可供选择的合成填料规格包括130 Å/300 Å孔径的3.5、5和10 μm颗粒。针对非典型样品或疏水性极强的肽,还可使用相同基质颗粒键合至C8或C4键合相的规格。
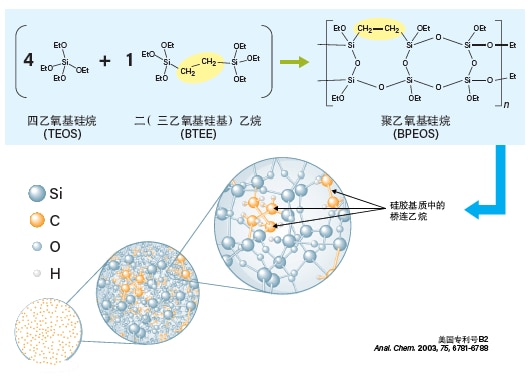
图7:BEH填料的合成过程
肽在不同规格色谱柱上的预计载样量见表1。
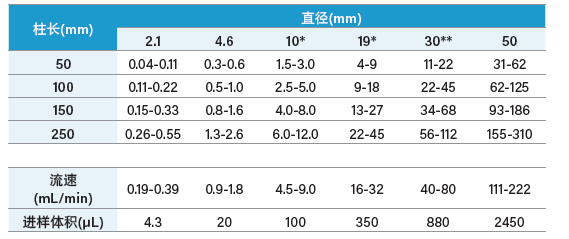
表1:反相色谱法分析肽的预计载样量(总载样量,单位mg)。
*5m和10mOBD制备色谱柱;**10mOBD制备色谱柱
许多因素都会影响制备色谱柱的载量。所列载量是各规格色谱柱采用合理流速和进样体积时的“平均”估算值。应考虑以下因素:
1. 肽的载量主要取决于具体样品的溶解性。
2. 如果需要较高的分离度,应降低载量。
3. 载量取决于上样条件,但小分子样品受此影响相对较小。
a) 肽上样一般在高水相条件下进行,通常会添加TFA。在这种条件下,体积载量几乎是无限的。载量受限于洗脱过程中的溶解性。
b) 干燥的肽可用DMF或DMSO等溶剂溶解。接下来通常使用TFA水溶液进行稀释(如前文所述)。
c) 在某些情况下,会先将肽溶于DMF或DMSO,然后再注入上述溶液。图表中的进样体积指南适用于此情况。
4. 合理的进样体积由采用相对较强的溶剂时50 mm柱长的色谱柱直径决定。增加柱长可兼容更大的进样体积,但二者并不成比例。使用较弱的溶剂时需要大幅增加进样体积。
5. 用户需要根据色谱柱直径选择合理的流速。柱长越长、粒径越小,柱压就越大,系统受到的限制也就越大。部分用户倾向于采用比分离小分子时更慢的流速来分离肽,因此会采用推荐流速1/2的流速,同时将梯度持续时间翻倍。
通过测试性质各不相同的一组(共四种)肽,我们确定了XBridge Peptide BEH C18肽分析专用柱(130 Å)用于标准肽分离的适用性。这四种肽的序列各异,但其主要属性见表2。
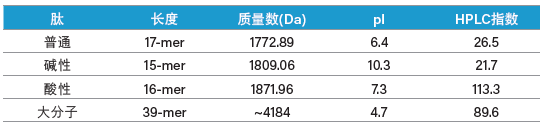
表2:测试组肽的特征。
由于既有弱酸性官能团(羧基)又有弱碱性官能团(氨基),肽属于两性物质。而由于同时带正电和负电,肽又被称为两性离子。如果肽溶解于具有一定氢离子浓度的溶液中之后,在所处的电场环境下不发生解离,则这个氢离子浓度即为肽的等电点(pI)。简而言之,等电点(pI)就是肽的净电荷为零时溶液的pH值。
如Browne、Bennet和Solomon所述,使用TFA:水:乙腈作为缓冲液体系从C18μBondapak色谱柱上洗脱肽时,利用HPLC指数可预测所需的乙腈比例。他们从生物基质中分离肽,并根据其氨基酸组成预测洗脱曲线。HPLC指数值越高,表示肽在C18色谱柱中的疏水性越强。显然,该值会随所用色谱柱和流动相而变化,但这个简单直接的体系能够提供一些有关目标肽性质的预测性信息。
图8所示为测试组中四种肽的色谱图,采用最常用的分析条件获得:以含有0.1%甲酸的水和乙腈溶液为流动相,梯度为流动相B在50 min内从5%增加至50%。四种模型肽均得到了清晰、对称、完全达到可接受标准的色谱峰。
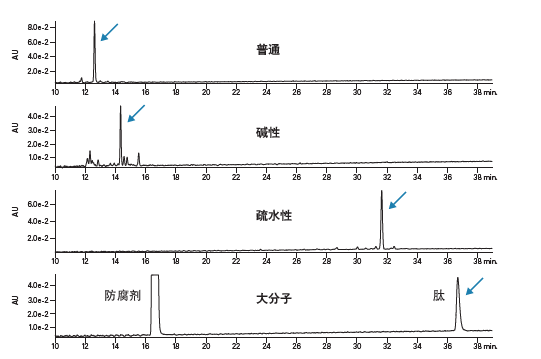
图8:标准条件下测试组肽的分离结果。
考虑使用300 Å孔径的色谱柱来提升大分子肽或疏水性肽的色谱分析结果很有必要。以测试组中分子量最大的肽(含39个残基,分子量在4000 Da以上)为例,其结果表明使用孔径更大的填料后峰形改善不明显(图9)。肽的洗脱时间稍有提前,差异大约相当于1%~2%乙腈梯度。使用130 Å孔径的填料时,对肽的大小有一定限制。大多数情况下要求肽具有40个以上的残基。
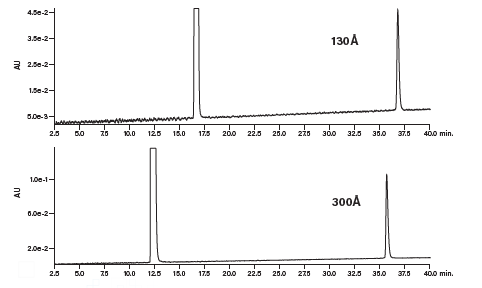
图9:孔径对大分子肽色谱分离效果的影响。
HPLC指数为113的疏水性肽在采用130 Å和300 Å填料进行分离时均洗脱得到了清晰的对称峰(图10)。肽构型(肽在溶液中的折叠方式)也会影响分离应用的首选孔径。正如没有关于肽载量的固定准则,理想孔径也受肽的不同特性影响。前文介绍的实验表明,拥有130 Å孔径、C18键合相的XBridge Peptide BEH肽分析专用柱是肽分离起始色谱柱的优质选择。
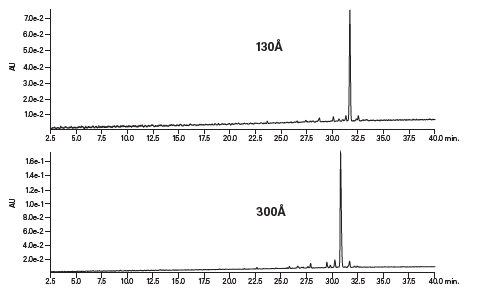
图10:孔径对疏水性肽色谱分离效果的影响。
从大规模肽分离的成本和效率角度出发,粒径问题至关重要。使用三种不同粒径的色谱柱分析碱性肽,结果显示分离结果一致(图11)。尽管采用大粒径色谱柱时色谱峰较宽且分离度稍差,但对于可扩展的BEH色谱柱填料而言,无论粒径是3.5、5还是10 μm,其化学选择性都是不变的。增大粒径对大规模分离有利,在可控的压力限值范围内,色谱柱直径越大,可采用的流速就越高,这都有助于提高载量、减少色谱分离运行次数并节省时间和资源。
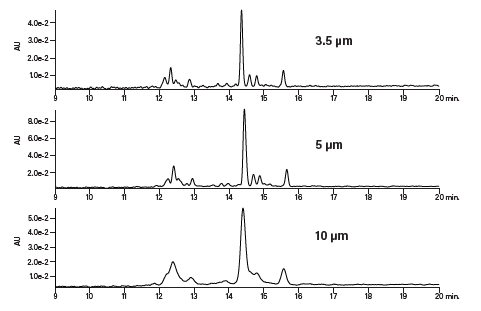
图11:粒径对碱性肽色谱分离效果的影响。
尽管肽自身的特性给成功分离粗制混合物中的肽增加了难度,但制备型色谱的基本原则17, 18仍然适用。采用通用梯度(例如流动相B从5%增加至50%,或从5%增加至95%)和反相色谱柱的标准肽分离方案适用于大多数情况,但对于某些具有独特性质的肽,有时也需要专门开发分离方法,以满足纯度、上样量或收率要求。一般通过改变流动相溶剂、改性剂、梯度斜率、温度、pH或进样方法来改进分离方法。上述每个因素都会影响分离操作、色谱分析质量以及分离最终能否成功。
溶剂的作用
流动相由三种组分组成:弱溶剂、强溶剂和改性剂。反相色谱分析通常使用水作为弱溶剂。尽管甲醇、乙醇和异丙醇均可用作强溶剂,但一般首选乙腈,因为乙腈的粘度低、溶剂强度稍高并且适用于短波长UV检测范围(185~205 nm)。使用乙腈通常可得到理想峰形,而且该溶剂易于通过蒸发去除,在分离和后处理过程中的副反应也更少。此外,乙腈良好的UV透光率还能提高信噪比,从而改善峰检测结果。不过,有些需要对所得的肽进行生物测试的用户可能不会选择乙腈。改用醇类(例如乙醇)可缓解乙腈可能会带来的毒性残留问题。不考虑生物相容性问题,使用丙醇或乙腈与丙醇的混合物通常可提高大分子或疏水性肽的溶解性,并使溶液中可能形成的聚集体碎裂。使用异丙醇: 乙腈(70:30)作为洗脱溶剂对碱性肽分离结果的影响如图12所示。主峰与最邻近的污染洗脱物之间的分离度得到了改善,而且保留时间缩短了近一半。由于醇类的粘度较高,使用含醇类的流动相时通常需要升高柱温。
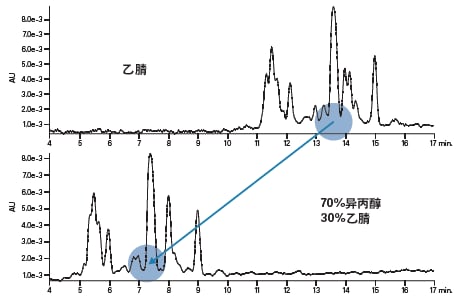
图12:溶剂对碱性肽洗脱效果的影响。
流动相改性剂的作用
采用反相色谱进行肽分离时需要向流动相中添加极性改性剂,因为肽同时带正电荷(氨基端)和负电荷(羧基端),这会降低肽对填料疏水性表面的亲和性。侧链保护基团也可能带电荷,如图13所示。改性剂通过调节pH改变弱酸或弱碱性侧链的离子化程度,还可与肽形成离子对。通过操控上述机制可优化特定样品的分离。
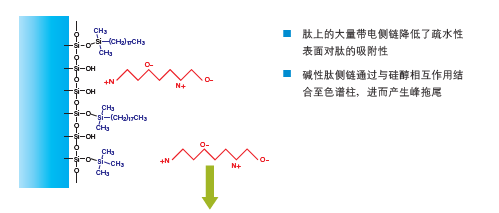
图13:采用不添加改性剂的水性溶液对肽进行反相色谱分离时的保留效果。
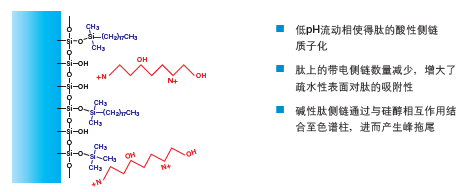
图14:甲酸对反相色谱中肽保留效果的影响。
甲酸可降低流动相pH,从而保护肽的酸性侧链并中和部分负电荷(图14)。减少氨基酸带电侧链数量可提高肽与色谱柱疏水性表面的亲和性,有助于改善分离效果。尽管色谱柱表面的大部分硅醇也可以通过质子化去除,但仍存在会与肽结合的游离硅醇。肽-硅醇相互作用会以拖尾峰的形式出现在色谱图中。
三氟乙酸(TFA)是最常用的改性剂,它通过不同的机制与色谱柱和样品发生相互作用(图15)。低pH使得酸性肽侧链质子化,同时通过形成离子对中和碱性侧链,从而抑制肽侧链与游离硅醇的结合,防止出现峰拖尾。电荷减少以及离子对的形成共同改善了保留效果,因此洗脱时需要提高有机溶剂浓度。
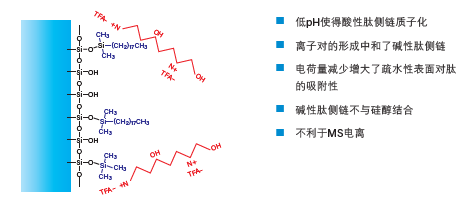
图15:三氟乙酸对反相色谱中肽保留效果的影响。
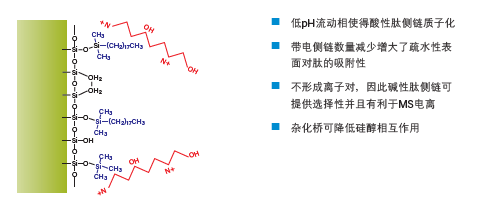
图16:酸性流动相与杂化颗粒色谱柱。
亚乙基桥杂化颗粒色谱柱的优势在于它能够消除硅醇相互作用(图16)。分析人员无需再使用TFA来缓解峰拖尾现象,因为这种基质填料与肽之间的相互作用很弱。另一方面,利用甲酸(FA)或TFA均可在保持良好峰形的同时改变分离的选择性。根据保留性差异及洗脱顺序的变化,我们可对纯化条件进行调整,如图17所示。星号标识出了两次分离中的同一种肽污染物,证明甲酸(FA)和TFA的确能够使选择性发生明显并且有意义的改变。
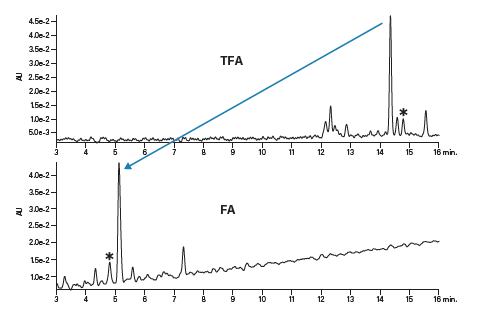
图17:改性剂对碱性肽分离效果的影响。
提高PH的作用
提高pH也可改变肽与亚乙基桥杂化颗粒色谱柱表面之间的相互作用。在碳酸氢铵等缓冲液的作用下,高pH可使酸性肽侧链去质子化并离子化(图18)。碳酸氢铵还可使碱性肽侧链去质子化并与之中和,从而减少肽所带的电荷,提高其与疏水性色谱柱表面的亲和力。碱性肽侧链不会与剩余的少量残留硅醇结合,有效减少了峰拖尾。除上述优势外,碳酸氢铵还具有挥发性,可以相对容易地从纯化后的肽产物中去除。氢氧化铵(用量0.1%)也可用于提高流动相pH,而且易于从收集到的馏分中蒸发去除。
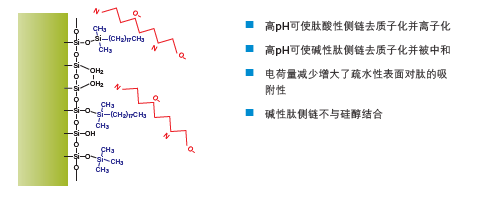
图18:pH对反相色谱中肽保留效果的影响。
极端pH会改变分离的选择性(图19和图20)。采用反相填料分离时,酸性肽(图19)在低pH条件下的保留性更好,原因是所有负电荷都已被中和,肽会与疏水性色谱柱表面发生强烈的相互作用。而在高pH条件下,肽的保留时间会缩短,原因是其携带更多负电荷,无法强力吸附到色谱柱填料上。在本例中,峰形未受影响,但洗脱顺序发生了变化,这一点可应用于方法开发或肽的正交表征策略。与预期相同,碱性肽(图20)在极端pH条件下的表现与酸性肽相反。在高pH条件下,肽的碱性残基去质子化并且不会离子化。由于肽与色谱柱之间的相互作用强烈,洗脱时需要提高有机流动相的比例。选择性的变化(pH 10条件下分离度提高)说明较高的pH对于实现分离高纯度肽的最终目标更有利。
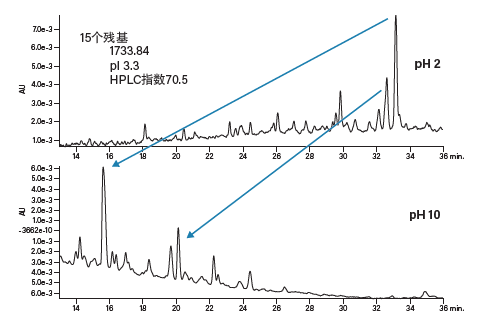
图19:流动相pH对酸性肽(pI 3.3)分离效果的影响。
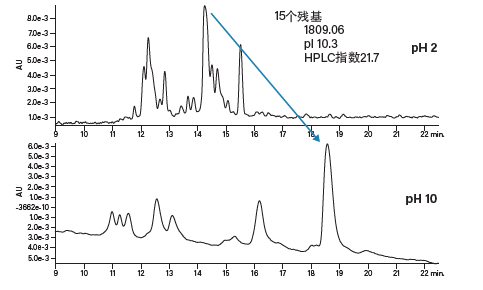
图20:流动相pH对碱性肽(pI 10.3)分离效果的影响。
注意:杂化颗粒色谱柱可兼容高/低pH流动相,但使用硅胶基色谱柱填料时切勿采用极端pH的方法条件。pH过低会使键合相裂解。高pH会破坏硅胶颗粒色谱柱基质。请务必查看制造商针对硅胶基色谱柱给出的建议pH范围限值。
温度的作用
温度控制是色谱分析中最常用于确保分离重现性的手段。温度控制对于分离和纯化而言的价值还体现在其它几个方面。溶解性有限的疏水性肽是非常难纯化的棘手样品之一。提高分离温度可提高疏水性肽的溶解性,通常还能改善色谱峰形。这最终将有助于提升分离产物的纯度和回收率,使分离更加快速、高效。由于不同温度下色谱分离的选择性不同,因此加热色谱柱是优化具体样品分离结果的一种非常方便的手段。此外,流动相粘度和系统整体压力也会随温度升高而降低。较低的系统压力可减轻系统、接头和色谱柱的负担,最终提高运行稳定性。
虽然温度控制是分析级色谱方法常用的控制手段,但制备级色谱方法却不常利用温度这个参数来操控色谱分离,原因有二。首先,大直径色谱柱难以从外部均匀加热。其次,高流速分离实际上发生在流入溶剂的温度下。虽然电热毯和柱温箱可满足小规模分离的加热需求,却无法均匀加热大尺寸色谱柱。色谱柱直径和柱长方向形成的温度梯度会对色谱分离产生不利影响。
能够有效加热色谱柱的方法是在柱头加设溶剂预加热环,并将加热环和色谱柱完全浸入已平衡至所需温度的水浴中(图21)。持续流经预加热环的溶剂可使色谱柱内部达到平衡,与此同时水浴则能稳定色谱柱外部环境。由于采用窄内径管路,因此溶剂预加热环导致的谱带展宽可忽略不计。流入的样品也将通过柱头吸附再次聚焦。

图21:大规格色谱柱的温控配置。
下图展示了分离测试组肽中的碱性肽(图22)和酸性肽(图23)时实施温度控制的效果。在这两个示例中(红框突出部分),碱性肽的样品组分在60 °C条件下分离效果更好,而酸性肽粗制混合物组分在40 °C条件下分离效果更好。然而,上述观察结果纯属巧合,因为无论是对于酸性肽还是碱性肽,要预测其最佳分离温度几乎都是不可能的,该温度取决于每种肽序列的具体特性。
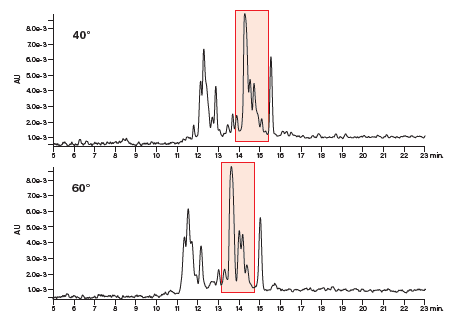
图22:温度对碱性肽分离效果的影响。
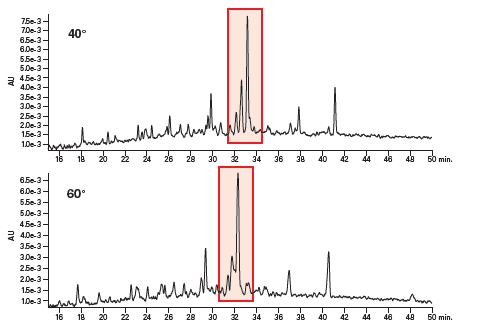
图23:温度对酸性肽分离效果的影响。
改变溶剂、流动相改性剂、pH和温度都会对肽分离效果产生显著影响,这些参数中任何一个或将它们联用均可作为方法开发工具用于优化色谱分离方法。选用一根填充稳定杂化颗粒的色谱柱(例如XBridge Peptide BEH肽分析专用柱),可减少肽分离所需的色谱柱数量和筛选时间,从而简化纯化过程。图24所示的碱性肽色谱分离结果展示了小幅改动对分离效果产生的影响。对于性质独特的肽,选用其它色谱柱填料可能会对优化分离效果有所帮助。
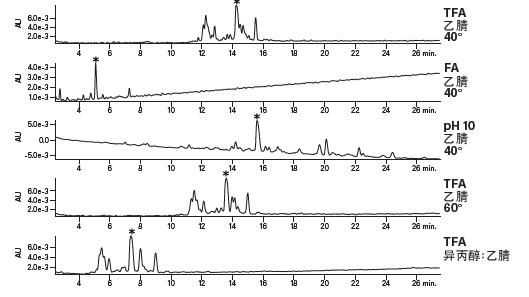
图24:在不同条件下采用XBridge Peptide BEH C18肽分析专用柱分离碱性肽的结果。
梯度聚焦
色谱分离和纯化遵循的物理和化学原理与分析级分离相同。但在制备型实验中,科学家们采用高载样量通过大型色谱柱分离化合物,为了提高收集到产物的纯度和回收率,必须设法提高分离度。设置平缓梯度是提高分离度的首选方法,但改变整个分离方法的梯度斜率会造成峰展宽并延长整体运行时间。分段梯度和梯度聚焦可以只降低分离中需要提高分离度的部分的梯度斜率,而不会延长整体运行时间(图25和26)。
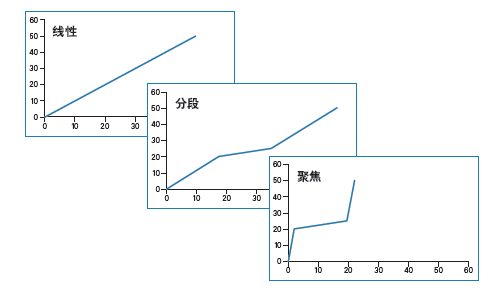
图25:线性梯度、分段梯度和梯度聚焦示意图。
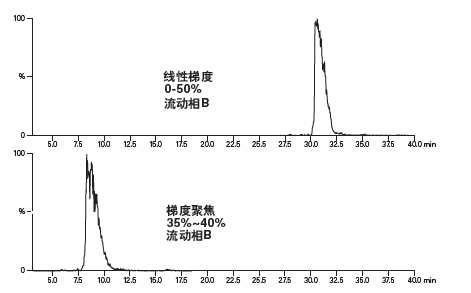
图26:线性梯度和梯度聚焦条件下的肽洗脱结果。
线性梯度一般是指在给定时间段内有机溶剂组分比例从低到高变化的梯度(例如流动相B从5%增加至50%,或从5%增加至95%),常被用于样品筛查。如果样品组分之间分离度良好并且运行时长合理,线性梯度也可用于制备级色谱分离。分段梯度保持梯度平缓部分(即方法中的梯度聚焦部分)前后的梯度斜率不变,因此可使这些分离阶段的色谱图保持不变。梯度平缓部分(即色谱方法中的梯度聚焦部分)的梯度斜率较低,能够有效分离目标峰与邻近其洗脱的杂质。梯度聚焦只以产物为目标。溶剂强度会从上样时的低浓度迅速升至产物峰洗脱的预期浓度以下约5%。一般来说,色谱图中平缓梯度部分的斜率为原始分离梯度斜率的五分之一,直至产物峰洗脱的预期浓度以上约3%结束。一旦梯度平缓部分结束,流动相的有机溶剂比例就会迅速升高,冲洗色谱柱中的所有剩余污染物。由于肽混合物非常复杂,一般在有机溶剂比例改变0.25%~0.33%/柱体积时分离度最佳,这个斜率比分离小分子和相对简单的肽样品时通常采用的斜率(一般为原始筛查梯度斜率的五分之一)稍低。
在设计梯度聚焦以及执行分析级到制备级分离的基本放大时,会用到系统体积。系统体积又称延迟体积或死体积22,其定义是从梯度形成处到柱头之间的体积,包括HPLC流路中的所有组件、泵头、脉冲阻尼器、混合器、进样器定量环和管路的体积。在进行几何放大时,若分析级方法和制备级方法的梯度斜率保持不变,由于存在系统体积,必须在梯度开始之前设置一段等度保持。该等度保持在小规模方法中可能是若干个柱体积,在大规模方法中可能是部分柱体积。通过在初始条件中设置等度保持,可补偿分析级分离与制备级分离之间的系统体积差异,从而确保实际的梯度起始时间点完全相同。
采用流动相A为纯溶剂,流动相B含适合的UV吸收剂(丙酮,2 mL/L)的分级梯度(表3),根据图27和图28所示的步骤和计算方法可轻松计算出系统体积。
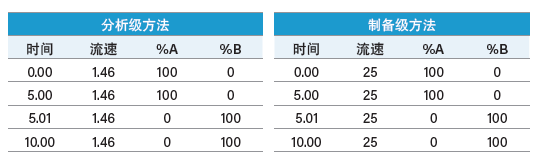
表3:用于测定分析型系统和制备型系统的系统体积的分级梯度。
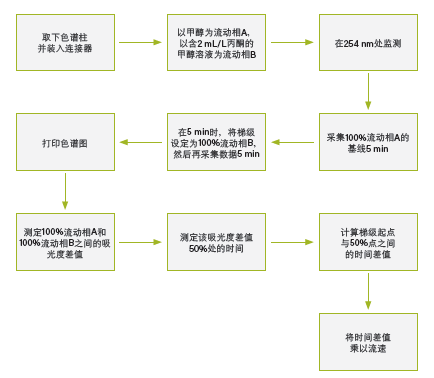
图27:确定系统体积的步骤。
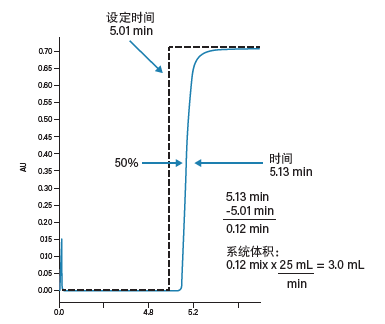
图28:系统体积计算方法。
尽管系统体积、色谱柱体积和肽洗脱时的强溶剂比例可以估算,然后根据这些估算结果制定分级梯度或梯度聚焦以节省时间,但通过实验确定系统体积并记录结果用于后续实验也是值得一试的方法。只要不改变HPLC管路且方法流速与测定系统体积时的流速保持一致,系统体积将始终恒定。通过实验确定系统体积之后,可轻松计算系统改动(例如更换进样器定量环规格),而无需进行其它体积测定。系统体积确定之后,可用于计算梯度聚焦。
设计梯度聚焦
梯度聚焦的设计通常基于粗制样品混合物的分析结果,但其步骤与修改初始制备级运行所用梯度时的步骤相同。使用下面的公式可轻松制定梯度聚焦。假设梯度聚焦设计基于如下梯度:
4.6 × 100 mm色谱柱,系统体积1.0 mL,色谱柱体积1.097 mL*
峰保留时间= 7.76 min

*色谱柱体积可通过网络计算工具确定,也可通过计算柱体体积确定,计算公式为V =πr2h。不同方法得到的结果会稍有差异,因为有些计算工具从液体体积中减去了色谱柱填料体积。只要始终采用同一种方法进行计算,就不会影响色谱分离。
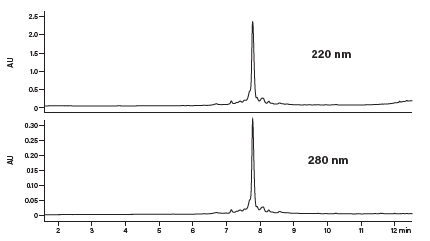
图29:粗制合成肽的HPLC分析结果。
图29所示为采用该梯度分析粗制合成肽得到的色谱图。
计算梯度形成点与检测器之间的补偿体积
![]()
示例:
![]()
计算溶剂到达检测器所需的时间

计算达到峰洗脱浓度的时间
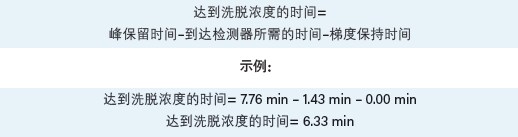
计算峰洗脱%

注:所有涉及百分比的计算都只使用绝对值,例如,应计算45 × 6.33 min,而非0.45 × 6.33。
计算试运行梯度斜率(按单位色谱柱体积对应的溶剂变化百分比计)

计算梯度聚焦斜率(按单位柱体积对应的溶剂变化百分比计)采用五分之一试运行梯度斜率。

以估算洗脱比例以下5%至该比例以上3%~5%为梯度聚焦区段。色谱峰在乙腈浓度为33.5%时洗脱。平缓梯度范围应为28%至36%乙腈。计算梯度聚焦区段的时间。

梯度聚焦以试运行初始条件起始,然后迅速升至峰洗脱百分比以下5%处。
图30中的上图所示为采用梯度聚焦条件分析粗制肽得到的色谱图。邻近洗脱的杂质得到了更好的分离,而将斜率降至初始斜率的五分之一后(下图),杂质的分离度最佳。本例明确展示了将梯度斜率降至0.25%~0.33%变化/色谱柱体积对复杂肽混合物分离的影响。注意,主要肽峰的保留时间仍为7 min左右,与原始筛选梯度所得的保留时间大致相同。因此,聚焦梯度可在不延长运行时间的前提下提高分离度。尽管总梯度的整体运行时间变长,但可以通过提前结束运行等技术手段加快大规模分离的运行速度。最终,我们通过对较平缓的梯度聚焦进行几何放大成功实现了肽分离。
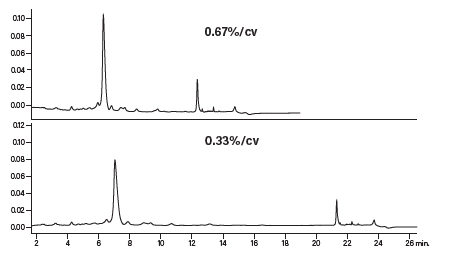
图30:梯度聚焦对粗制合成肽分析的影响。
进样
由于肽的溶解性因其组成和序列而异,目前还没有用于溶解肽的通用溶剂或技术。可选用的溶剂包括:含0.1%~2%三氟乙酸、甲酸或乙酸的水溶液、二甲亚砜、六氟异丙醇、6~12 M盐酸胍、二甲基甲酰胺、0.1%氢氧化铵或10 mM碳酸氢铵。有时制造商会针对不同类型肽的溶解提供实用指南24。肽溶解常常会得到溶于强溶剂且体积相对较大的样品。
对于传统制备型色谱系统(图31),注入溶于强稀释剂的大体积样品通常会导致色谱图畸变,从而减少可成功分离的产物量。随着上样量增加,目标肽与邻近洗脱杂质间的分离度也会降低。定量环中样品的任一端或柱头处存在的水性流动相都会导致样品沉淀,进而降低系统稳定性并缩短色谱柱寿命。
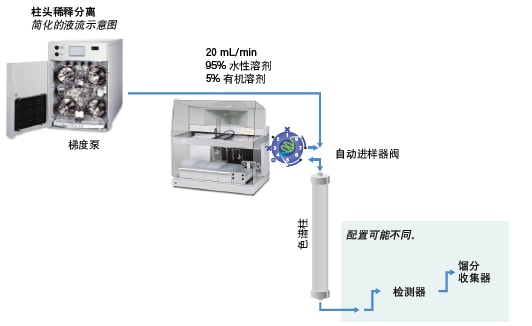
图31:标准梯度系统的管路配置。
传统分离方法会将溶于DMSO或其它强溶剂的样品注入系统,溶剂会携带样品分子立即流经色谱柱(图32)。在色谱柱内的强溶剂被稀释之前,样品不会被保留在色谱柱上。然而,当样品谱带被色谱柱保留时,各谱带已经展宽并在色谱柱床上相互重叠。样品各组分从色谱柱上洗脱时,其谱带之间分离不明显且纯度较差。
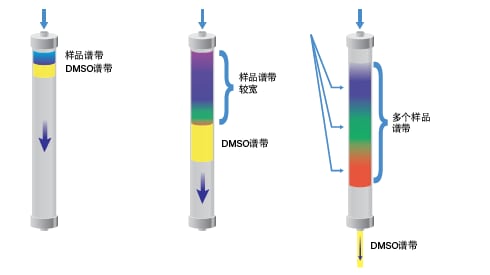
图32:以DMSO作为样品溶剂进行标准制备型分离的示意图。
柱头稀释(ACD)是一种替代进样技术,可在执行大体积强溶剂进样的同时提高样品溶解性、色谱柱载量和分离度。配备ACD的色谱系统可在柱头处用水性流动相稀释溶解于强溶剂的样品(图33)。样品将被快速稀释,然后吸附到色谱柱上。由于输送速度极快,不会形成沉淀。强溶剂会在样品洗脱开始前迅速被冲出色谱柱。梯度开始后,样品组分被洗脱,得到分离完全、峰形清晰的小体积窄峰(图34)。由于样品组分峰之间的分离度得以改善,我们可以增大进样量,从而减少分离所需的进样次数。在实际操作中,采用柱头稀释通常可将色谱柱上样量提升3~5倍(图42)。柱头稀释还可以使样品不容易在定量环或柱头处发生沉淀,因此能改善系统稳定性。发生高压关闭的频率降低,色谱柱寿命也更长。
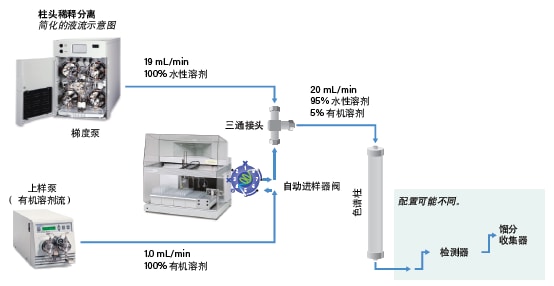
图33:配备柱头稀释装置的系统管路配置示意图。
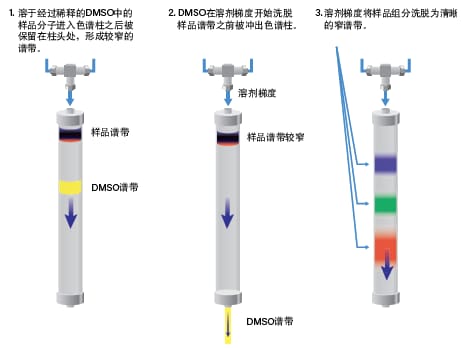
图34:以DMSO作为样品溶剂,采用柱头稀释进行制备型分离的示意图。
肽分离实例
制备型色谱技术原理适用于包括肽在内的所有类型的分子。以下示例介绍了应用前文所述的方法优化因子在研究环境下进行肽分离的典型工作流程。分析人员可根据实验室的具体实验要求对此流程进行修改。
本例使用长度为17个氨基酸,含有3个碱性残基、2个酸性残基、8个非极性残基以及4个极性残基的肽。将样品溶于二甲亚砜,进行涡旋混合和超声处理,然后用0.45 μm GHPAcrodisc注射式过滤器进行过滤。这种肽的单同位素质量数为1772.9 Da,并且具有以下电荷态:
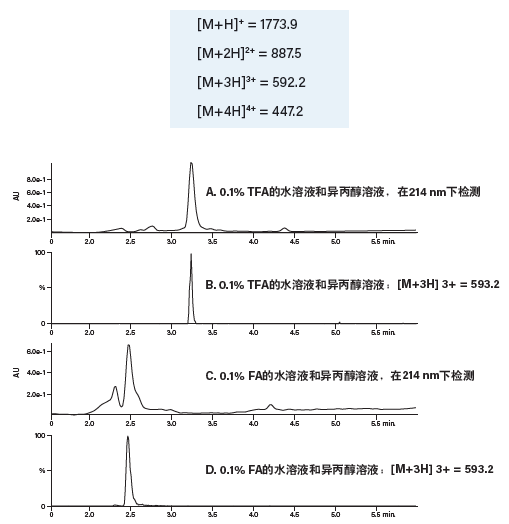
图35:分别以TFA和FA作为改性剂分离粗制肽的结果。
粗制肽分析
分别使用添加两种不同改性剂(0.1%甲酸和0.1%三氟乙酸)的流动相分析粗制肽样品,以确定哪种改性剂的分离效果更好。尽管乙腈是最常用的流动相有机组分,但为了便于说明,本例改用异丙醇作为流动相有机组分。分析结果如图35所示,使用改性剂TFA(A和B)时得到的产物峰比使用甲酸(C和D)时得到的产物峰峰形更清晰,与污染物之间的分离度也更高(分析温度均为40 °C)。此外,我们还评估了25 °C和60 °C下的分离,结果表明40 °C下的峰形和样品组分峰分离度最佳(图36)。小幅提高温度还可以降低因使用异丙醇作为流动相有机组分而升高的系统背压。
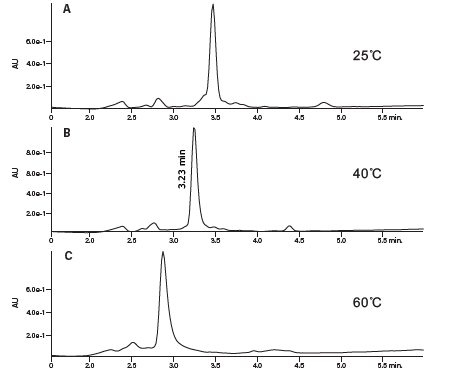
图36:在三种温度条件下评估粗制肽分离所得的结果。
梯度聚焦
对粗制肽分析方法的流动相改性剂和温度进行优化之后,我们又通过设置梯度聚焦来提高目标肽与邻近洗脱污染物峰之间的分离度。4.6 × 50 mm色谱柱的柱体积为0.698 mL,系统体积测定值为0.77 mL。分析粗制肽的HPLC方法如下:

计算梯度形成点与检测器之间的补偿体积

计算溶剂到达检测器所需的时间

计算达到峰洗脱浓度的时间

计算峰洗脱%

注:所有涉及百分比的计算都只使用绝对值,例如,应计算30 × 1.73 min,而非0.30 × 1.73。
计算试运行梯度斜率(按单位柱体积对应的溶剂变化百分比计)

计算梯度聚焦斜率(按单位柱体积对应的溶剂变化百分比计)采用五分之一试运行梯度斜率。

以估算洗脱比例以下5%至该比例以上3%~5%为梯度聚焦区段。色谱峰在乙腈比例为10.85%时洗脱,因此将平缓梯度设置为乙腈在6.37 min内从5%升至13%。

梯度聚焦以试运行初始条件起始,然后迅速升至峰洗脱百分比以下5%处。
确定梯度聚焦之后,评估粗制肽样品的分离效果(图37A)。一个很小的杂质峰在产物峰之前洗脱,但几乎观察不到。上样量翻倍后(图37B,72 μg),杂质峰更加明显,但主峰仍然相对较纯。上样量增加到原上样量(36 μg)的四倍之后,所得色谱图中的杂质峰更加明显,若将该上样量几何放大至采用更大规格色谱柱的制备型分离,极有可能会影响所得产物的纯度(图37C)。在分析型色谱柱上进样256 μg样品时,杂质峰完全与主峰共洗脱(图37D)。
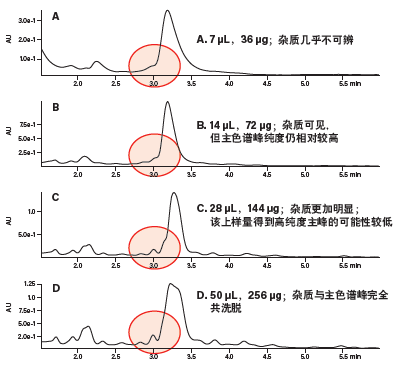
图37:采用分析型色谱柱和梯度聚焦方法进行的上样量研究。
放大至制备级分离
选择分析型色谱柱上72 μg的上样量用于几何放大至制备级方法。此上样量较为保守,与放大上样量最小的分离相比,放大该上样量能够提高我们通过较少的进样次数获得适量纯产物的可能性。
载样量与色谱柱体积成正比,可通过制备计算器或计算以下公式中的M2来确定,其中:
M1是色谱柱1的载样量
M2是色谱柱2的载样量
L1和d1分别是色谱柱1的柱长和直径
L2和d2分别是色谱柱2的柱长和直径

将44.03 mg粗制肽溶于5 mL DMSO并过滤(浓度8.80 mg/mL)。根据上述计算结果,将4.6 × 50 mm分析型色谱柱上72 μg的上样量几何放大至19 × 100制备型色谱柱之后的上样量为2.4 mg。根据粗制肽浓度8.80 mg/mL计算进样体积:
![]()
将分析级梯度聚焦放大至制备级时,应考虑两种规模的系统体积(表4)。制备型系统的延迟体积本来就比较大,还包括用于加热色谱柱的5 mL预加热环以及2 mL进样定量环。考虑到这些部件引入的系统体积,其余系统管路引入的体积2.75 mL是非常合理的。产物峰按时间进行收集(图38)。
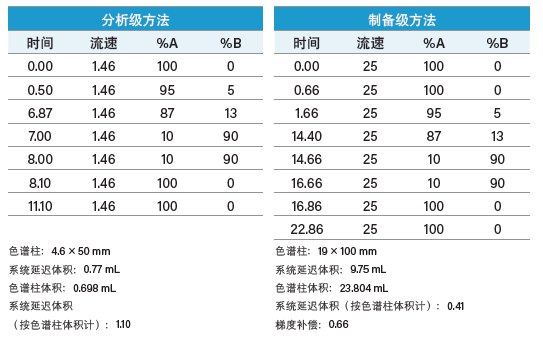
表4:梯度放大。
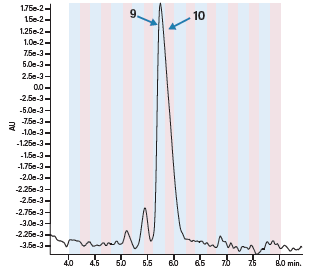
图38:定时收集。
馏分分析
两种馏分中都收集到了肽产物。这两种馏分的纯度都非常高,如图39所示。各馏分分析以及空白分析的谱图中2.25 min处洗脱的宽峰很可能是流动相中的低浓度三氟乙酸离子对改性剂造成的27。TFA的疏水部分通常会在色谱柱上累积,然后在梯度过程中洗脱。另一次未连接色谱柱的空白进样分析结果中没有任何色谱峰(图40),表明该污染物并非来自任何系统组件(例如进样器或阀)。
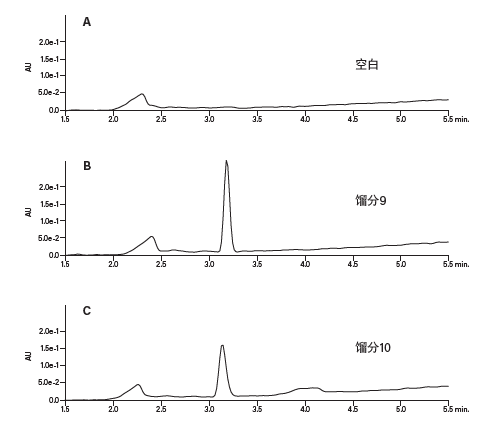
图39:馏分分析。
柱头稀释
尽管已经分离出了高纯度肽,但增加每次进样的上样量可提高后续实验的纯化效率,以及减少纯化出所需产物量需要执行的色谱运行次数。如前所述,柱头稀释法可通过简单更改系统管路配置有效管理大上样量的进样操作(图33)。
尽管应用柱头稀释进行肽分离时,单位柱体积对应的%B变化率与经过几何放大的传统分离方法相同,但我们对梯度表进行了修改,纳入了辅助上样泵引入的有机溶剂部分(表5)。
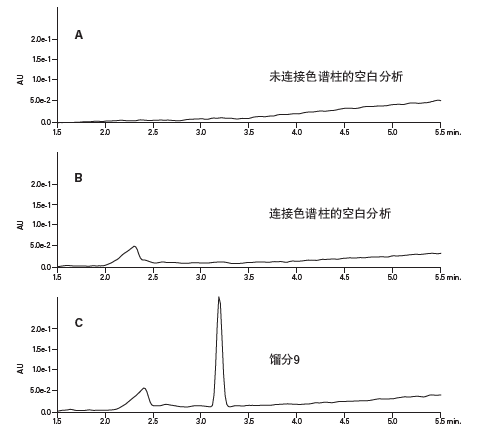
图40:TFA中的疏水部分。
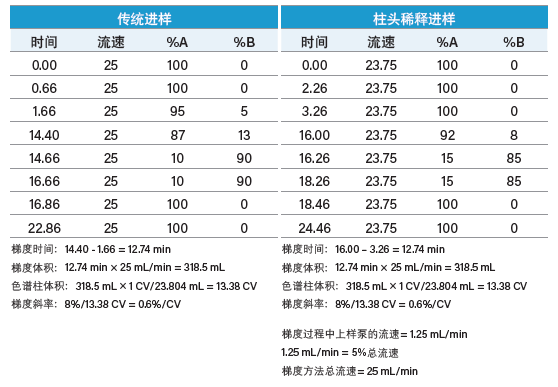
表5:传统进样与柱头稀释进样方法的梯度比较。
柱头稀释泵直接将有机溶剂送入样品定量环,并按照程序以总流速的5%运行。因此,采用柱头稀释法时,色谱泵的流速从传统方法的25 mL/min降至23.75 mL/min。注意,总流速仍为25 mL/min (23.75 mL/min + 1.25 mL/min)。由于柱头稀释泵直接与进样器相连,因此我们在初始条件的梯度起始阶段设置了时间足够长的保持步骤,以确保定量环中的样品能够完全输送至色谱柱。该系统配置有2 mL定量环,初始保持步骤设置为0.66 min。柱头稀释方法的保持步骤时间计算方法如下:
![]()
1.60 min + 0.66 min(原始制备级方法的保持步骤时间)= 2.26 min(柱头稀释方法的保留步骤时间)
梯度方法中A和B的比例也根据柱头稀释泵的影响进行了相应修改。梯度聚焦从5%流动相B开始,升至13%流动相B。由于柱头稀释泵以总流速5%(即1.25 mL/min)的恒定流速输送异丙醇,因此柱头稀释方法中流动相B的比例分别设定为0%和8%。注意,尽管柱头稀释方法的梯度设置稍有不同,但实际上其梯度是与传统方法完全相同的。由于这种肽在流动相B比例很低时洗脱,因此柱头稀释方法中的5% B实际上会持续较长时间,将传统制备型方法从0% B升至5% B的时间合并到了柱头稀释方法的保持时间中。为了方便读者理解,柱头稀释方法分两行列出了上述两个步骤。由于流动相B的比例为配合柱头稀释泵输送的5% B而降低,流动相A的比例必须升高5%以确保梯度与原始的传统进样方法相同。如果色谱系统的进样序列中设有冲洗步骤,务必确保所有清洗管路均被灌注了强清洗溶剂。
由于几何放大后的大规模分离在40 °C下进行,因此柱头稀释进样也要维持该温度。溶剂预加热环安装在水性溶剂流的三通接头前(图41)。
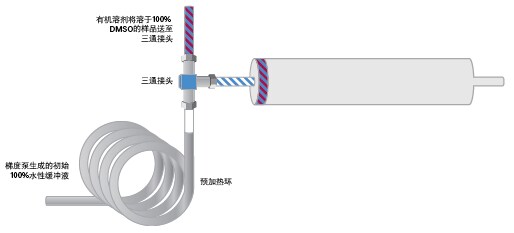
图41:采用柱头稀释和温度控制装置的上样示意图。
然后将溶剂预加热环、三通接头和色谱柱浸入水浴。开始梯度分离前应先等待压力稳定(即表明系统已经达到平衡)。传统管路配置下的最大进样量为2.4 mg,而采用配置有柱头稀释装置的系统时,我们向色谱柱中注入了该进样量五倍的样品,即12 mg (1.36 mL)(图42和图43)。按时间收集馏分,后续分析采用原始的0%~30% B筛选方法。收集到的馏分纯度极高,并且与采用传统进样技术的制备级方法得到的馏分纯度相当(图44)。
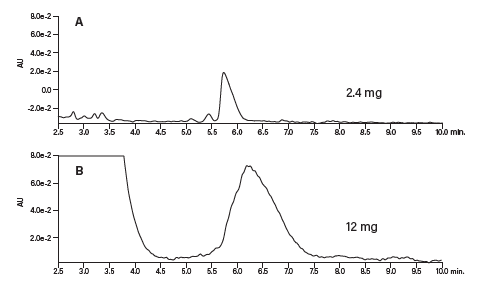
图42:传统进样与柱头稀释进样结果比较。
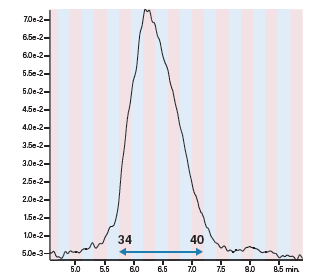
图43:采用柱头稀释法的制备型分离结果。
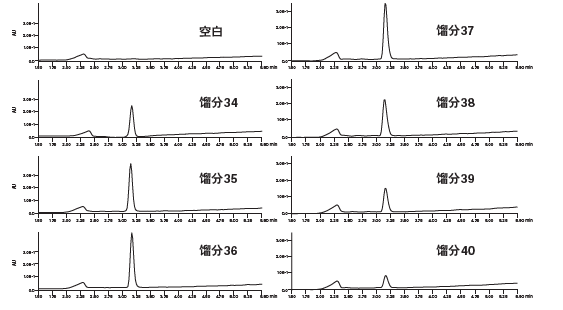
图44:采用柱头稀释法进行分离的馏分分析结果。
关于疏水性肽的特别注意事项
将一种由12个非极性和3个极性不带电氨基酸残基组成的疏水性肽溶于二甲亚砜。采用如下的制备级梯度聚焦,在19 × 100 mm色谱柱上通过传统进样配置的色谱系统执行分离。由于目标肽疏水性极强,因此需要降低流速28和上样量,并在60 °C下进行分离。
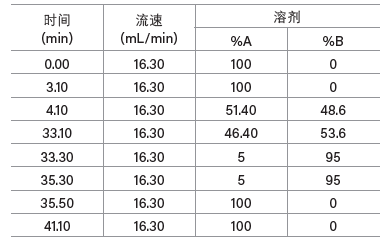
尽管这种肽适合采用柱头稀释分离,但增大色谱柱载样量会有产生沉淀的风险。这种肽在乙腈浓度约为50%时洗脱,而上样时的5% B(根据前文示例)还远低于洗脱所需的溶剂强度,因此肽在柱头稀释过程中容易发生沉淀。在上样过程中提高色谱泵提供的有机溶剂比例能够缓解可能出现沉淀的问题。一般在分离疏水性极强的化合物时,将梯度方法中有机溶剂的初始比例设置为低于化合物预期洗脱比例20%~25%的值可防止样品发生沉淀,同时保留柱头稀释技术的优势。以下是修改后的柱头稀释梯度,我们在19 × 100 mm色谱柱上采用该梯度进样分析了原方法进样量五倍的样品(图45)。
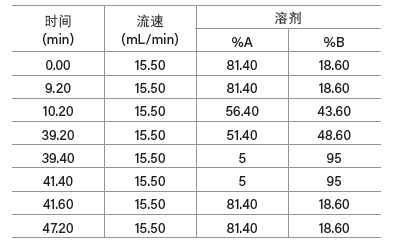
梯度起始时的比例为48% B(43.6% B +来自柱头稀释泵的5% B),结束时的比例为53%乙腈,用时29 min,斜率为单位柱体积变化0.49%,与传统进样采用的梯度变化率相同。柱头稀释泵泵送100%乙腈,将来自5 mL定量环的肽样品带入三通接头,在此达到色谱泵流动相的初始条件,23.6% B(18.6% B +来自柱头稀释泵的5% B)。方法起始阶段9.2 min的保持时间可确保样品完全上样至色谱柱。柱头稀释泵以恒定流速0.8 mL/min运行,即总流速16.3 mL/min的5%。
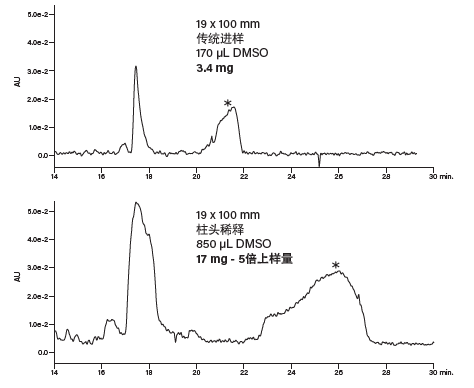
图45:疏水性肽上样量比较。
清洗色谱柱
无论是用于分离小分子还是大分子,色谱柱都需要经常清洗。出现高背压、高背景噪音以及与样品无关的假峰均表示色谱柱需要清洗。
防止污染物在色谱柱上累积是延长色谱柱寿命的理想方法。建议在进样任何样品前先进行过滤。在色谱柱之前设置在线过滤器或保护柱有助于去除颗粒及其它不需要的混合物组分。在每次分离结束后使用2~3倍色谱柱体积的高浓度有机溶剂冲洗色谱柱能够系统地去除污染物。最后,柱头稀释可使样品保持溶解状态,防止发生高压关闭,并且可使样品组分顺利通过纯化系统到达馏分收集管或废液桶。
若背压突然升高,很可能是系统某处(如样品定量环、管路、色谱柱或检测器流通池)发生了样品沉淀。在色谱系统保持泵送的条件下,按照从废液管开始回溯至泵的顺序有条理地松开各HPLC接头,必定能够找出导致高背压的原因。若背压逐渐升高,可能是由于多次进样后色谱柱内累积了杂质,该问题可通过多种方式解决。升高温度并反复运行快速梯度、采用高浓度有机溶剂长时间冲洗色谱柱,或者进样“清洗溶剂”(例如DMSO或1%~10%甲酸)都可以去除色谱柱内的污染物(图46)。
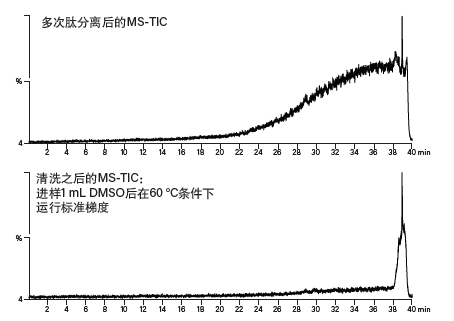
图46:色谱柱清洗。
去热原是指去除色谱柱内可能会污染终产物和引发过敏反应的内毒素多糖29,通常需要使用高浓度氢氧化钠(1 M)冲洗色谱柱一小时或更久,但该方法不适用于我们目前使用的色谱柱。
| < 上一页 |
下一页 >
|