核心技术
流路与硬件
随着现代制备型SFC仪器技术不断进步,有关制备型SFC的许多难题都已被攻克⁷。图7所示为常规Prep SFC仪器的流路设置。SFC的基本流路与HPLC相同,包括二元泵和方法控制装置,使用进样器将样品送入流路,采用色谱柱进行分离,然后进行峰检测和馏分收集。除此之外,SFC还应用了其它技术,主要用于控制CO2的压缩和膨胀。这些装置包括热交换器(HE)、背压调节器(BPR)、气液分离器(GLS),并且几乎全部采用高压不锈钢管路。
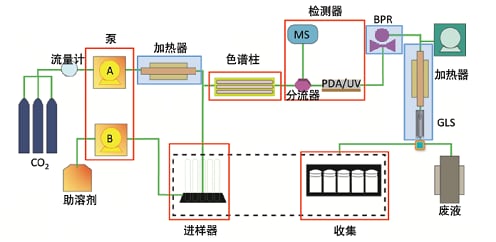
图7. 常规SFC流路,红框突出的部分与HPLC相似(泵、进样器、色谱柱、检测器、收集装置),蓝框突出的部分不同于HPLC(加热器、背压调节器(BPR)和气液分离器(GLS))。(该图所示为改性剂流进样和开床式收集采用的典型管路设置。)
各个组成部分的注意事项如下:
泵送:SFC和LC一样,都采用二元泵系统输送溶剂“A”(对于SFC而言始终为CO2)和溶剂“B”(通常为极性有机溶剂,如甲醇)。CO2可按体积泵送(体积流量,分析级分离常用),也可按质量泵送(质量流量,制备级分离常用),具体取决于分离的规模。由于CO2可压缩,因此等体积CO2未必等质量(密度差异)。只要流速可不受环境条件影响保持重现性,上述两种输送方式均有价值。大多数情况下,CO2会在泵之前或者泵头处冷却,然后以液体形式泵送,目的是减少流动相密度偏差。另外,所有密封件、单向阀、管路和接头都必须能承受可压缩高压流体,不能泄漏。由于CO2极易通过任何开口扩散,即使少量泄漏也会显著影响系统性能和色谱分离。无论是管路泄漏、密封件还是单向阀造成的CO2泵送问题,不仅会改变保留时间和选择性,还会影响压力(密度)控制和基线噪音。
进样:SFC有混合流和改性剂流两种常用进样模式,我们将在“SFC的进样策略”部分详细介绍。混合流SFC进样方案包括降压步骤,其目的是在上样之前排空定量环中的所有CO2。设有混合流和改性剂流两种进样模式的系统有时也会将降压步骤用作安全预防措施。降压操作通常由二级排放阀完成。这种进样设置有一个缺点,即进样时增加了系统的柱外体积,这可能会导致峰展宽和分离度损失。使用小内径管路尽可能多地减小柱外体积,有助于减小峰展宽。
柱温箱和加热:在SFC中,压力和温度是影响分离性能的方法参数,因为它们会影响流动相密度。因此,我们必须对流动相和色谱柱进行适当的加热和温度控制。如果温度控制不当,色谱柱温度梯度会对峰形和分离度产生不利影响。大多数SFC系统通过在柱温箱中加热色谱柱、预加热流动相或将这两种方法联用来控制温度。
正确选用色谱柱填料(手性和非手性)对SFC至关重要,因此色谱柱筛选是SFC应用的必要步骤⁷。许多SFC系统的柱温箱内都配有切换阀,供用户在多根色谱柱之间切换。当需要不同色谱柱填料来纯化多种不同的样品和目标物质时,色谱柱筛选尤为重要。
检测器:SFC可兼容纯化会用到的所有典型检测技术,例如UV/Vis、PDA、MS和ELS,而且可在同一系统中使用多个检测器。一般将UV/Vis和PDA检测器连入主流路,因为它们是非破坏性检测器,被用于主检测。应根据SFC所采用的压力来确定上述检测器的最佳流通池规格。MS和ELS等破坏性检测器配合分流器接入,分流器可对分流比进行相对控制,并通过调整溶剂来优化检测信号。系统可记录或使用多个检测器的信号(或通道)来触发馏分收集,有效扩展了分析型和制备型SFC技术的应用范围。上述检测器在SFC中的应用将在本章“SFC中的光学和MS检测”部分进行详细介绍。
背压调节器(BPR):控制流经色谱柱的流动相密度是SFC仪器设计十分重要的方面之一,因为所有化合物的溶解性和保留因子都与流动相的密度密切相关。密度控制主要通过控制系统压力实现。背压调节器是专用于控制系统柱后压力(背压),使其维持方法指定压力的自动化设备。要实现稳定、可重现的色谱分离,柱后压力必须保持恒定(保持设定值),即便在梯度条件下和不同运行之间也应如此。
尽管我们认为CO2在高于74 bar(约1073 psi)和31 °C时就会转变为超临界状态,但一般不建议在接近临界点的条件下运行系统,因为该范围内温度或压力极小的变化都会显著改变CO2密度⁵。因此,就保留性能和分离度而言,在该范围内开发的方法稳定性较差。另外,如果使用助溶剂,则低压条件下更容易发生相分离,进而导致基线噪音。所以大部分SFC方法都使用较高的压力设定值,一般在100 bar (1450 psi)以上。
收集触发器:Prep SFC的馏分收集可通过阈值、时间和斜率收集模式在多个通道和检测器处进行(具体定义见表3)。系统运用布尔逻辑执行更加智能的收集,这种收集要求同时满足多个条件才能触发。收集条件可以是模式的组合,例如阈值和时间,也可以是检测器信号的组合,例如UV阈值和质量数确证数据。

表3. 制备型SFC中各收集模式的定义。
要使目标化合物达到理想回收效果,收集时间点延迟也很重要,必须在检测器和收集系统之间设置合适的延迟时间。与Prep HPLC相同,收集延迟时间取决于流速。但对于SFC,收集时间点还会随流动相组成和压力而变化。借助补偿溶剂和能够解决CO2膨胀问题的其它技术,我们现已经能够在流速一定的不同条件下更好地控制触发收集的时机。
SFC的进样策略
制备型分离需要在分离色谱柱上加载大量样品。一般来说,样品稀释剂最好与流动相匹配或与流动相极性相近,以便尽可能减少峰展宽和峰畸变。但这对SFC来说难以实现,因为液态CO2难以控制。为了使样品稀释剂匹配SFC流动相,人们此前已尝试过两种方法。第一种方法使用预柱捕获样品,然后用中性气体(通常为氮气)去除其中的稀释剂,再流动相将样品吹扫至色谱柱。第二种方法是直接将SFE(超临界流体萃取)与Prep SFC联用。这两种方法都能提高上样量,但都因过于耗时而无法提升整体效率⁶。
目前,SFC应用可采用两种进样方式:混合流进样和改性剂流进样(见图8)。在混合流进样模式下,流动相整体(CO2和助溶剂)将吹扫定量环并携带样品进入色谱柱。混合流进样的常见问题是强稀释剂效应导致峰畸变和保留时间漂移。标准做法是将样品溶解于极性改性剂(助溶剂)中。使用强溶剂(如甲醇)将导致固定相无法吸附某些分析物,从而引发峰流穿或峰畸变。保留性差的峰受到的影响更大,峰畸变也更严重⁶。随着进样体积增大,极性溶剂团会在流动相中产生局部干扰,使色谱峰进一步发生畸变,还会导致分离度下降。该进样方法也需要降压,这也会影响进样上样量和重复性。已有研究表明,采用混合流进样时使用极性与CO2相近的稀释剂(例如正己烷、庚烷或其它非极性溶剂)可改善峰形(图9)。
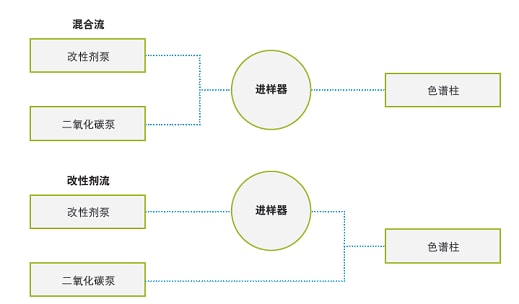
图8. 混合流和改性剂流进样示意图⁶。
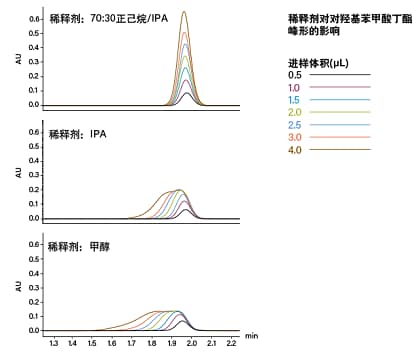
图9. 在采用混合流进样的SFC中,样品稀释剂强度对峰形的影响。
第二种进样方法是改性剂流进样,该方法先将样品注入流动相的有机溶剂(助溶剂)中,然后再与CO2混合。此法与LC纯化的柱头稀释方案类似,其思路是在不影响流动相整体强度的前提下加入样品,使得整个进样和运行过程中溶剂百分比始终保持设定值,以此降低稀释剂效应。使用这种进样方法时,稀释剂应当与分离使用的助溶剂相匹配;不过也可以使用其它稀释剂。改性剂流进样可改善峰形和分离度,还可提高进样体积和上样量(图10)。
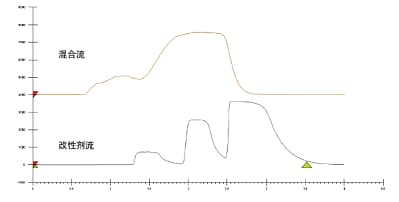
图10. 采用混合流(上图)和改性剂流(下图)进样技术,以10%助溶剂的方法条件进样分析2 mL风味物质(上样量40 mg)所得的分析结果。
如果在助溶剂比例较低的情况下使用改性剂流进样,会因助溶剂泵的流速较低而增加样品进入柱头所需的时间,而由于流动相具有高扩散性,进样时间增加可能会导致峰变宽(相较于混合流进样)。不过,相较于助溶剂比例较低的大体积混合流进样,改性剂流进样的峰形仍有所改善。尽管混合流进样能将样品更快地送至色谱柱,但此法在上述条件下产生的干扰远多于其带来的益处。随着助溶剂比例增加,进样技术的选择变得不那么重要,但在低助溶剂比例的情况下,改性剂流进样明显更具优势⁶。
SFC中的光学检测和MS检测
PDA和UV/Vis检测
SFC中的光学检测有一些特殊的注意事项。流动相密度变化以及CO2与助溶剂间的折射率差异会导致UV/Vis和PDA检测器出现基线漂移和基线噪音(图11)。上述现象在梯度条件下尤为明显。对于PDA检测器,使用单波长通道和能够降低基线噪音并提高灵敏度的波长补偿可以调整基线(图12)。对于UV/Vis检测器,设置单波长可减少基线噪音和漂移。
硬件方面,市面上已经有能够耐受SFC应用的高压条件的专用流通池,而且适用于Waters 2998 PDA和2489 UV/Vis检测器。设计者研究这类流通池的光程、形状和流通池材质等特性之后,针对SFC应用中的检测进行了优化。
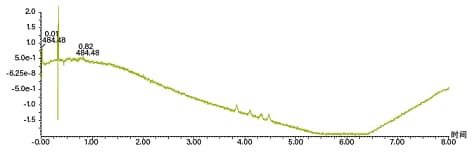
图11. PDA最大吸收色谱图,展示了SFC梯度条件下典型的基线漂移和基线噪音。
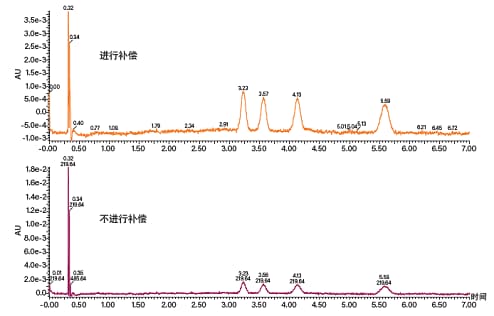
图12. 在低浓度检测中,PDA检测器采用(上图)和不采用(下图)波长补偿时采集到的色谱图。
MS检测
SFC关键的优势之一是兼具正相选择性和MS兼容性。SFC所采用的CO2不仅能替代质谱不兼容的溶剂(例如正己烷和庚烷),还能通过气体膨胀协助MS源中的雾化和颗粒形成。SFC兼容多种MS仪器的ESI、APCI和双模式采集。Waters ACQUITY QDa质谱检测器因其易用性成为了Prep SFC的理想之选。但是,在助溶剂比例较低的条件下,离子数量通常不足以获得最佳检测信号。因此,通常需要在分流时添加调节溶剂(或补偿溶剂)来强化MS信号。典型调节溶剂为甲醇、水和添加剂(通常为氢氧化铵或甲酸)的混合物。在不同流速条件下还可使用多种其它混合调节溶剂,具体取决于用户偏好、MS仪器类型和应用的规模。图13展示了Waters ACQUITY QDa质谱检测器在使用和不使用调节溶剂的条件下得到的MS-ESI检测结果。
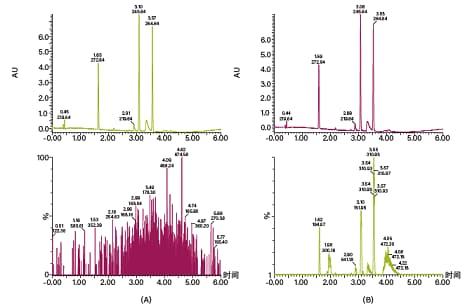
图13. 展示了SFC中MS检测结果的色谱图。上方色谱图为UV谱图,下方为(A)不使用调节溶剂时的QDa-MS信号和(B)使用调节溶剂(95:5:20 mM甲醇/水/氢氧化铵,流速0.6 mL/min)时的QDa-MS信号。
ELS检测
SFC还兼容ELS检测。与MS检测相同,ELS检测也需要分流并添加补偿溶剂以改善信号。由于SFC流动相极易挥发,因此需要额外加入其它溶剂用于携带样品和改善ELS检测器的信号。在操作方面,ELSD的控制与SFC中LC的操作相似。
PREP SFC馏分收集:CO2膨胀注意事项
在考虑Prep SFC的收集控制时,流动相的膨胀特性非常重要。临界条件下(31 °C和74 bar)的纯CO2转化为大气压条件下(1 bar和15 °C)的CO2时,体积将膨胀约250倍。在制备型SFC系统中,高压CO2出口在背压调节器(BPR)处。随着输出CO2的压力增长,其体积膨胀倍数也呈指数式增长。在二元体系中(例如典型的SFC流动相),体积膨胀倍数随CO2比例下降和有机溶剂比例的升高而减小13。膨胀发生的同时流动相溶解能力也将下降,这是溶解能力减弱和Joule-Thomson冷却效应造成的。冷却效应还有可能导致形成干冰,进而堵塞管路。膨胀控制不当会使收集流路发生峰畸变,影响馏分纯度,还会使得目标化合物被吹扫入废液,或者在收集点处因汽化而损失,从而降低回收率。
为了成功收集馏分,SFC仪器采用多种策略来控制CO2膨胀及其影响。首先,为了缓解冷却效应及相关问题,仪器会在紧接背压调节器之后的初始膨胀点处对流动相加热。其次,在许多情况下,流动相中都会添加有机补偿溶剂,这不仅能让化合物保持溶解状态,还有助于通过降低CO2体积比来控制膨胀。更好地控制膨胀能够改善BPR后的峰形并提高回收率。最后,CO2将被排出或去除。该操作一般采用相分离装置完成,例如高压旋风分离器或气-液分离器(GLS)(图14)。
高压旋风分离器将流动相中较重的部分(液体)推向旋风分离器外侧和底部,让CO2气体从其中央和顶部离开。高压旋风分离器的优点是不需要补偿溶剂(即使助溶剂比例较低),因为收集阀将维持CO2的溶解能力,直至其到达旋风分离器中进行相分离。但该设备也有许多缺点。高压收集系统需要采用耐高压材料(例如不锈钢),馏分回收过程中可能会发生的喷溅和膨胀会增大安全风险。此外,用户采用这类系统只能进行位置有限的“闭床式”收集。气-液分离器(GLS)是一个只需低压条件的替代选项,拥有诸多优势。低压系统可采用耐压级别较低的材料,能够大幅降低安全风险。尽管收集时通常需要额外使用溶剂,但该方法可在低压条件下更彻底地去除CO2,因此能够执行开床式收集,大大增加了可收集到的馏分种类,并扩展了该技术的适用性。
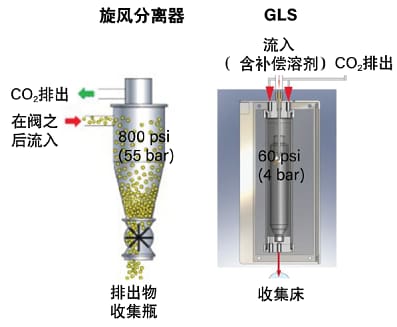
图14. 制备型SFC馏分收集过程中用于分离并去除CO2的高压旋风分离器和气-液分离器的示意图。
广泛的选择性和适用性
Prep SFC可显著提升纯化过程的选择性。SFC一般采用正相分离,不过该技术非常灵活,用户可采用某些常规RPLC色谱柱及溶剂来扩展化合物兼容范围。具有跨正反相分离的选择性是SFC的一大显著优势,该特性使得用户通过单一平台即可实现正交分离,有效简化了整个纯化过程。
SFC兼容性:溶解性
SFC一般在正相色谱分离模式下运行10。在典型运行条件下,流动相中大部分是非极性的液态CO2,辅以少量极性有机溶剂,分离所用的色谱柱填充小颗粒填料,固定相极性相对较强且具有各种官能度。由于流动相粘度低且采用小颗粒色谱柱,因此SFC主要被用于小分子应用。不过,采用SFC的大分子应用也在不断扩展。换言之,化合物是否适用于SFC主要取决于其溶解性。SFC的溶解性范围极为广泛。事实上,一般而言任何能够溶于有机溶剂的样品都适用于SFC。这一点很有优势,因为许多样品制备技术得到的都是溶于有机溶剂的样品,因此可直接进样到Prep SFC仪器中。
关于化合物在有机溶剂中的溶解性,分配系数(通常称为LogP)是一个非常有用的参数。LogP通常被用于衡量化合物的亲脂性或疏水性。具体而言,分配系数P是指某种化合物在两种不混溶溶剂(通常是水和正辛醇)中溶解达到平衡状态时,浓度的比率(图15)14。由于CO2是非极性溶剂,因此LogP值能够很好地指示化合物在SFC条件下的行为。化合物的LogP值越低表示其极性越大,在CO2中的溶解性越差,对极性色谱柱填料的亲和性越高;而化合物LogP值越大则极性越小,在CO2中的溶解性更好,对色谱柱的亲和性越差。上述特征在RPLC中恰好相反,RPLC的流动相为极性,而固定相为非极性。

图15. 分配系数计算
对于分析型(UPC2)应用,可使用低上样量和低浓度的样品分析LogP值介于-2至9的化合物。但对于制备型SFC,在上样量较大时使加入CO2的样品保持溶解状态非常重要。对于含有强极性或亲水化合物且浓度和含量达到制备级的样品,应在进样至系统之前测试其溶解性。所用方法一般是将样品溶于适合的有机溶剂,然后加入少量正己烷或庚烷。如果样品溶液中有沉淀析出,一般认为其不适合采用制备型SFC处理。
Prep SFC的一个缺点是对强极性化合物的溶解性差。但可通过向流动相的有机部分中添加少量水(作为添加剂,一般少于5% v:v)来扩大适用于SFC的样品极性范围。水可以提高亲水化合物的溶解性,从而使这类化合物的分离和纯化成为可能。因此,SFC的适用性得以扩展至肽、蛋白质、核酸碱基以及其它亲水性分析物的研究10。尽管该技术在极性应用中的适用性已经得到证实,但在使用制备型SFC时仍需谨慎,避免样品产生沉淀或在系统出口处形成干冰。
SFC的适用性:助溶剂
助溶剂的选择是SFC色谱方法开发和优化的关键。无论是对于正相还是反相液相色谱,都对溶剂互溶性有所限制。正相色谱使用的脂肪烃和反相色谱使用的水都限制了分离方法适用的溶剂极性范围。而对于SFC,超临界CO2与反相和正相有机溶剂均可混溶,涵盖从甲醇到庚烷的各种有机溶剂,为分离方法开发提供了广泛的溶剂选择(表4)。广泛的溶剂选择范围极大扩展了SFC可兼容的应用。
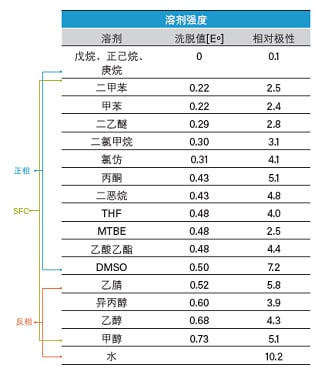
表4. 溶剂及其与NPLC、RPLC和SFC的兼容性列表。
SFC的适用性:色谱柱
反相色谱主要采用有限的几种固定相进行分离,一般是C18或与之类似的疏水色谱柱。跨反相(非极性)和正相(极性)色谱范围的多种手性和非手性色谱柱填料均可用于SFC(表5)。碱性、中性和酸性化合物在大部分色谱柱上均可成功洗脱,这表明Prep SFC适用于具有各种化学官能团的色谱柱⁷。能够使用多种色谱柱可视为一个缺点;但同时这也为纯化特定化合物时优化选择性提供了可能⁷。现代Prep SFC固定相赋予了SFC将应用范围扩展至手性和非手性纯化的潜力³。值得一提的是沃特世专为SFC应用而设计的Viridis和Torus色谱柱,这些色谱柱产品稳定性更高、选择性范围广并且峰形更佳,还能减少使用添加剂的需求。表6所示为适用于各种Prep SFC应用的沃特世色谱柱系列产品列表。色谱柱的选择是方法开发和优化的关键。
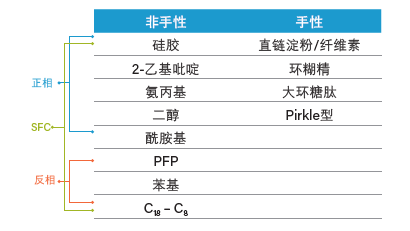
表5. 非手性和手性色谱柱及其与NPLC、RPLC和SFC的典型兼容性列表。
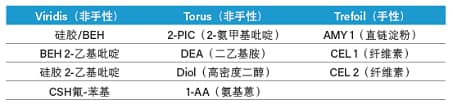
表6. 沃特世公司适用于各种Prep SFC应用的固定相。
手性分离
到目前为之,SFC仍是手性化合物分离的理想色谱解决方案,相较于正相HPLC等其它色谱技术,SFC可显著提高分离效率和分离速度。手性分离一般采用正相HPLC进行。使用SFC执行手性分离,所需时间明显缩短,同时还能提高分离度并减少溶剂用量。因此,手性色谱柱被大量应用于SFC环境,而且不仅被用于手性应用,还被用于分离非对映体、代谢物、位置异构体以及其它结构相关化合物⁷。其中纤维素和直链淀粉基固定相尤为常用,不过SFC也兼容其它手性固定性。在纯化上述化合物时,SFC拥有诸多优势,例如所得馏分纯度更高、分离效率更高,以及因溶剂用量小而实现的成本节约等等。图16所示为使用正相HPLC和SFC对苄氯菊酯对映体和非对映体进行手性分离的结果。HPLC没能分离出全部四个色谱峰;但SFC在更短的时间内完全分离出了四个色谱峰,且使用的色谱柱更短15。
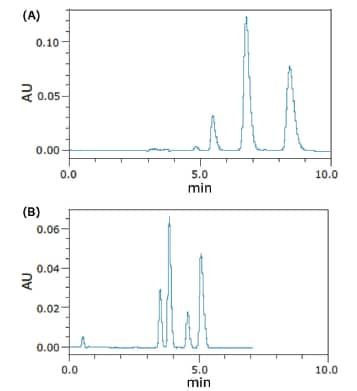
图16. 使用正相HPLC (A)和SFC (B)分离苄氯菊酯立体异构体得到的色谱图15。
| < 上一页 |
下一页 >
|